Развитие периодического закона Д. И. Менделеева
В 1869 году, когда был сформулирован Периодический закон, научный мир знал только о 63 элементах. На 2021 год известно 118 элементов, продолжаются попытки получения новых.
Формулировка Периодического закона означала лишь начало развития химии и знаний о периодичности свойств химических элементов. Несмотря на то, что изначально предсказания Менделеева были встречены со скепсисом, в итоге они стали основой для целого ряда химических открытий.
В развитии периодического закона принято выделять 2 периода:
- химический;
- физический.
Химический этап связан с открытием элементов Периодической системы, которые предсказал Менделеев:
- 1875 — открытие галлия французским химиком Полем Эмилем Лекок де Буабодраном;
- 1879 — открытие скандия шведским химиком Ларсом Фредериком Нильсоном;
- 1886 — открытие германия немецким химиком Клеменсом Александром Винклером. Позже оказалось, что данный элемент по свойствам совпадает с менделеевским экасилицием;
- 1900-02 — преобразование Периодической системы в связи с появлением в таблице дополнительной группы элементов, включающей инертные газы.
Данное преобразование завершило химический этап развития Периодической системы.
Физический этап развития Периодического закона был начат в связи с тем, что химия не могла в полной мере объяснить причину периодичности свойств химических элементов. Физический этап развития Периодического закона привел к изменениям в естествознании, которые оказали на науку революционное влияние.
Дальнейшее изменение Периодической системы было связано с открытиями физики.
Физический этап можно условно разделить на периоды:
- 1869-97 — открытие электрона, радиоактивности и установление делимости атома;
- 1911-13 — разработка модели атома;
- 1913 — открытие изотопов и разработка их системы, также открытие закона Мозли, позволяющего определять заряд ядра и номер элемента в Периодической системе химических элементов;
- 1921-25 — разработка теории Периодической системы на основании знаний о строении оболочек атомов;
- 1926-32 — квантовая теория строения атома и Периодической системы.
В связи с открытиями физики таблица начала менять свой изначальный облик.
Скрытые менделеевские числа
Менделеевские числа к самому Менделееву отношения не имеют. Их предложил в 1984 году британский выдающийся физик Дэвид Петтифор. Предложил в одной коротенькой статье, которая наделала много шума, вошла во многие западные учебники и вызвала множество вопросов. Было понятно, что эта концепция работает, но было совершенно неясно, откуда она взялась и почему она работает. Мы разобрались с этими вопросами. В конце 2020 года вышла наша статья на эту тему.
Что такое менделеевские числа? Это попытка развернуть двухмерную таблицу Менделеева в виде ряда элементов — такого, чтобы соседние элементы были максимально похожи друг на друга. Попробуйте это сделать, и вы сразу же натолкнетесь на большие сложности. И сразу же понятно, что порядковый номер элементов в таблице Менделеева не дает вам такой последовательности. Потому что в конце периода и в начале периода — огромные скачки свойств.
Например, водород и гелий идут подряд в таблице, но у них очень мало схожего. Или посмотрите на фтор, неон, натрий. Все три элемента обладают диаметрально противоположными характеристиками, а они ближайшие соседи. И, понятное дело, нужно каким-то другим образом эту таблицу развернуть в ряд, чтобы соседние элементы обладали похожими свойствами. Делать это совершенно без скачков невозможно: свойства атомов будут скакать. Математическая задача состоит в том, чтобы расположить атомы так, чтобы изменение их свойств было максимально плавным.
Вообще, такую формулировку, как «максимальная плавность», я произношу впервые. Петтифор таких слов не говорил, он просто показал «фокус-покус». Он сказал: «Вот есть такая последовательность, откуда я ее взял, вас не касается». Это единственная статья такого рода во всей научной литературе! И вот, мол, возьмите такую последовательность, и вы увидите, что в химическом пространстве на пересечении осей Y и Х, на которых вы откладываете элементы этой странной последовательности менделеевских чисел, будут разные химические системы. И соседние точки на химическом пространстве будут обладать похожими свойствами. Это означает, что, если у вас есть какой-то хороший материал, в этом химическом пространстве вокруг него будут кучковаться другие хорошие материалы. Так появляется какая-то очевидность и наглядность.
Соединения с особо хорошими свойствами у вас занимают какую-то компактную часть химического пространства. Мало того что это дает вам наглядность и интуицию, куда смотреть в поисках хорошего материала, вы можете создать алгоритм! Допустим, вы ищите хорошие сверхпроводники, и, если они скучкованны, вы быстро понимаете, куда двигаться, и фокусируетесь на этой области. И так вы сможете найти самый твердый материал, самый магнитный материал, самый сверхпроводящий материал и т. д.
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны
Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу
Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
«Что же из этого следует?»
Можно ли с помощью этого открыть что-то классное? Конечно, можно! И Петтифор это делал не для развлечения. Если речь идет о двойных или тройных соединениях, вы можете на листочке бумаги без компьютера прикинуть, к какому классу соединений будет относиться ваше вещество, какого типа свойств от него ожидать. Кстати говоря, мы строили модели. Знаете, что мы делали? Мы взяли химическое пространство, вычеркнули из него большую часть данных, около половины, а потом попытались восстановить эти данные по оставшимся. И все работает!
Есть приятные удивления, есть неприятные удивления. Начну с неприятных. Если вы смотрите на нашу последовательность или на петтифоровскую последовательность, там будут такие странные соседства (и это мы относим к толщине, которой мы пренебрегли): например, соседями оказываются железо и йод — не очень похожие элементы. В целом свойства у них не диаметрально противоположные. Но, конечно, сказать, что йод и железо — близнецы-братья, никому не придет в голову.
Что касается приятных сюрпризов: если вы посмотрите на этот ряд, то совершенно очевидно становится, куда класть водород. Среди химиков ведутся споры, похожие на борьбу с ветряными мельницами (и меня лично они забавляют), о том, как лучше рисовать таблицу Менделеева: короткой или длинной? Водород ставить над щелочными металлами или над галогенами? Так вот, правильный ответ: над галогенами. Он в последовательности менделеевских чисел — что в нашей, что в петтифоровской — ровно там, где фтор и хлор.
Напоследок хочу рассказать еще об одном исследовании. 14 октября 2020 года человечество впервые получило комнатную сверхпроводимость. Это экспериментальные результаты группы из США, которые были опубликованы в самом престижном научном журнале Nature. Я к этому исследованию не имею отношения, но очень впечатлен результатом и работой. Что это за соединение, непонятно, химический анализ сделать не удалось, как и определить кристаллическую структуру. Это удивительный пример: какая-то штука сверхпроводит при комнатной температуре, но что это за штука, пока никто не знает! Это было достигнуто при давлении свыше 2,5 млн атмосфер. Практического применения этот результат, к сожалению, не будет иметь. Я бы очень хотел создать комнатный сверхпроводник при нормальных условиях. 2,5 млн атмосфер, как в том американском исследовании, — это, конечно, чудовищное давление. Возможна ли комнатная сверхпроводимость при нормальном давлении — вот это вопрос.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
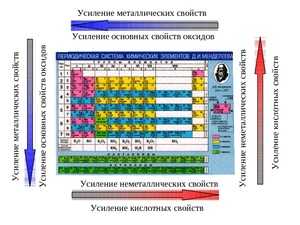
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
История открытия
Дэвид Петтифор придумал эти менделеевские числа, но никому не сказал, откуда он их взял. И этот вопрос у меня висел где-то в подкорке лет 15. С 2004 года я знаю про менделеевские числа, и у кого я ни спрашивал, никто не знает, что это за ерунда. Почти случайно я смог понять, что это такое. В кристаллохимии есть основной закон — закон Гольдшмидта. Он говорит (а это самая важная характеристика вещества): кристаллическую структуру определяют соотношения атомов и свойства атомов. Три свойства являются основными: это радиус, электроотрицательность и поляризуемость (два последних коррелируют, это почти одно и то же). И если вы построите это пространство: по оси Y у вас будет электроотрицательность, а по оси X — радиус, вы увидите, что точки, каждая из которых соответствует какому-нибудь элементу, имеют свойство располагаться в форме очень сильно вытянутого облака. И это означает, что вы можете сделать примитивное координатное преобразование, где главная координата у вас будет вдоль оси удлинения этого облака, а второстепенная будет перпендикулярна ей. Менделеевское число будет не чем иным, как главной координатой. То есть это наилучший способ описать химию элемента одним числом.

Такова природа. На самом деле еще Петтифор в 1984 году показал, что его менделеевское число, взятое непонятно откуда, с потолка, работает. Но, поняв принцип, как определять менделеевские числа, я смог переопределить их. Наша последовательность менделеевских чисел похожа на петтифоровскую, но есть серьезное отличие. И если вы посмотрите на то, как группируются соединения с похожими свойствами с нашим менделеевским числом, то качество группировки значительно выше, чем у Петтифора.
Мы поняли принцип, как построить химическое пространство, но в алгоритме фигурирует полное координатное описание. Второстепенная координата тоже должна учитываться там, где вы не ищете наглядность, а ищете точность. Подчеркну: наш подход не эмпирический. Эта идея понижения размерности пространства, в общем-то, тривиальна. Удивительно, что никто к этой идее не пришел раньше. И получается так: когда мы переопределяем последовательность менделеевских чисел, она работает лучше, чем петтифоровский вариант и чем те варианты, которые делались на искусственном интеллекте. Я получил огромное удовольствие от решения этой старинной загадочки.
Медиана, мода, среднее, разброс
Рассмотрим пример: исследование охватило 200 человек с ожирением. Вес участников исследования колебался от 105 до 203 кг. Это разброс значений, или дисперсия. Средний вес составил 120 кг — это среднее значение веса в выборке. К примеру, 30 из 200 человек имели вес 115 кг. Остальные весили по‑разному, поэтому 115 — оказалось самым «популярным» значением веса в выборке, то есть модой веса.
Даже на базе этих данных мы можем составить представление о том, как выражен изучаемый признак: большинство участников исследования весило ближе к 100 кг, и только немногие весили около 200. Кроме определения «чистого» веса можно, например, ранжировать (разделить) пациентов по индексу массы тела — ИМТ. Например, 1 — ожирение первой степени (ИМТ 30–35), 2 — ожирение второй степени (ИМТ 35–40), 3 — ожирение третьей степени (ИМТ более 40). И тут мы плавно подходим к понятию шкал переменных.
Преимущества созданной карты свойств химических элементов
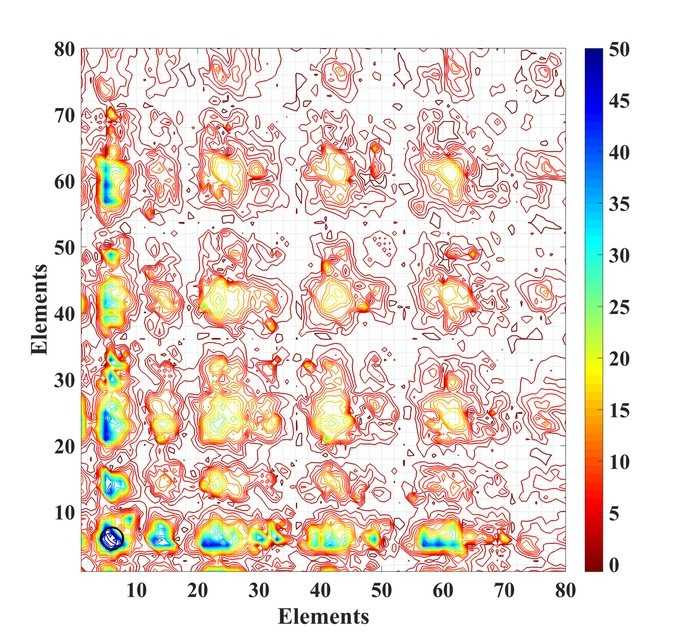
По мнению Оганова, большинство веществ имеют непостоянную валентность, а электроотрицательность взаимосвязана с поляризуемостью. По этой причине оставшиеся 2 свойства – радиус атома и электроотрицательность сводятся к единому математическому значению, образовывая числа Менделеева.
Используя эти показатели, ученые выявили менделеевские числа для существующих открытых атомов и применили их для создания особой карты характеристик химических элементов. В них вещества сгруппированы по различным параметрам, включая твердость, магнитные свойства и тд.
Благодаря изучению данных карт в будущем, поможет научным сотрудникам выявлять элементы с большой твердостью или особыми магнитными характеристиками, а также применять данную информацию для поиска аналоговых соединений.
Периодический закон Менделеева — в чём суть
Химические элементы, существующие в нашем мире, созданные самой природой или человеком, подчиняются правилу — Периодическому закону, который является основой химической науки.
После открытия в 1869 году Д. И. Менделеевым Периодического закона химических элементов данная наука перестала быть исключительно описательной. Стало возможным научное предвидение.
Суть закона Менделеева заключается в том, что свойства химических элементов, расположенных в таблице, а также свойства образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Периодический закон Менделеева был выражен в форме периодической системы элементов.
Периодическая система химических элементов Д. И. Менделеева состоит из 7 периодов — они представляют собой элементы, расположенные по горизонтали в порядке возрастания атомного номера (заряда ядра), и восьми групп (столбцов).
Периоды делятся на:
- малые — 1, 2 и 3;
- большие — 4, 5, 6 и 7.
Каждый, кроме первого, период начинается со щелочного металла, а заканчивается благородным газом. Слева направо в каждом периоде ослабевают металлические и усиливаются неметаллические свойства, что связано с возрастанием числа электронов на внешнем уровне каждого химического элемента и увеличением прочности их связи с атомом.
Группы делятся на подгруппы:
- главные или А;
- побочные или Б.
Сверху вниз в главных подгруппах усиливаются металлические и слабевают неметаллические свойства.
В главных подгруппах вместе с усилением металлических свойств увеличивается устойчивость соединений элементов в низких степенях окисления. В побочных подгруппах с ослабеванием металлических свойств увеличивается устойчивость соединений с высокими степенями окисления.
История открытия, какое имело значение
Первооткрывателем периодического закона является Д. И. Менделеев. Днем, когда был открыт периодический закон, считается 1 марта (17 февраля) 1869 г., когда ученый закончил работу над основным трудом, описавшим данный закон — «Опыт системы элементов, основанной на их атомном весе и химическом свойстве». Тогда с ним за звание первооткрывателя боролся Юлиус Лотар Мейер, который также создал свою систему химических элементов.
Существует легенда о том, что Дмитрий Иванович Менделеев увидел Периодическую систему химических элементов во сне. Однако сам ученый ответил так:
За основу своей классификации Д. И. Менделеев взял два свойства — химическое сходство элементов и их атомную массу. Ученый расписал на карточках основные свойства каждого элемента, после чего начал многократно переставлять их, чтобы найти закономерность.
Менделеев утверждал, что с ростом атомной массы элементов их свойства меняются, но не монотонно, как считали исследователи до него, а периодически. Свойства начинают повторяться после определенного количества элементов, однако они делают это не точь-в-точь, а с определенными изменениями.
Вторая версия Периодической системы появилась в 1870 году в статье «Естественная система элементов» в «Основах химии». Эта система больше похожа на современную: горизонтальных столбцов стало восемь, периоды остались в изначальном количестве, а каждый период был разбит на 2 ряда — для элементов основной и побочной подгрупп.
Для соблюдения периодичности химических элементов Д. И. Менделеев переписал атомные массы некоторых элементов, расставив их вопреки общим представлениям, а также оставил пустые клетки для неоткрытых элементов.
Первое определение химического закона звучало следующим образом:
С помощью составленной периодической системы Д. И. Менделеев смог предсказать открытие новых элементов, а также целый ряд их химических и физических свойств. Подтверждение правильности систематизации появилось уже в 70-80-х годах XIX века, когда были открыт галлий, скандий и германий, которые точно встали в установленные Менделеевым места в Периодической таблице.
Формулирование Периодического закона имело большое значение для развития химии. С открытием Периодической системы химических элементов Д. И. Менделеева мир химической науки перестал быть исключительно описательным, но получил возможность прогнозирования будущих результатов.
М±SD
Часто в научных статьях мы видим такие понятия, как дисперсия, стандартное отклонение, размах. Это одни из самых важных понятий в статистике, и обозначают они меру разброса значений изучаемого признака.

Разброс — показатель того, насколько значения признака отклоняются от его среднего значения.
К каждой шкале применима своя мера разброса. Например, уровень гемоглобина — это метрическая шкала. Для такой шкалы характерная мера разброса — это дисперсия, показатель разнородности значений признака. Дисперсия (D) измеряется в квадратных единицах признака, в случае гемоглобина — (г/л)2, поэтому для удобства изучения можно извлечь корень из дисперсии √D и получить стандартное отклонение (standart diviation — SD), которое обозначают буквой σ (сигма). Стандартное отклонение характеризует разброс в обе стороны от среднего значения.
Для меры разброса ранговых шкал более применим размах, разница между максимальным значением признака и минимальным: max — min.
Для шкалы Лайкерта можно использовать стандартное отклонение.
Тем не менее иногда в статьях и диссертациях можно заметить, что размах используется совместно со стандартным отклонением для метрических переменных.
Среднее обозначают буквой µ (Мю) или М. Таким образом, если средний уровень гемоглобина µ=96, а стандартное отклонение σ=20, то диапазон значений лежит в пределах µ±σ (М±SD), или, в нашем случае, 96±20, то есть диапазон от 76 до 116
Важно помнить, что в этом диапазоне будет лежать 68 % значений признака в случае нормального распределения, 95 % значений лежат в пределах двух сигм и 99 % лежат в пределах трех сигм, но об этом в следующем номере



























